保存硫酸亚铁要加入稀硫酸和铁粉:加稀硫酸防止Fe2+水解,加铁粉防止Fe2+氧化。有人提出异议 :“ 加人的铁粉和稀硫酸要发生反应,如何防止Fe2+解和氧化呢?”有人解释:“纯铁粉和硫酸反应不能完全进行,存在限度。”似乎这样解释有点牵强…有的认为纯铁粉和稀硫酸反应速度慢;有的认为纯铁粉和稀硫酸反应不能完全进行。铁粉、硫酸在保存硫酸亚铁溶液的作用是什么?硫酸亚铁溶液应该如何保存?长隆科技就此问题进行了探究。
实验探究和现象解释:实验中涉及的化学反应
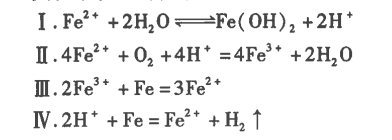
用电子天平准确称取2.78gFeSO4.7H2O溶于水,定容,准确配制100mL0.1mol/LFeSO4溶液待用。
新配制FeSO4溶液 的性质探究
新配制FeSO4溶液显淡绿色m用FE20型实验PH计测得0.1mol/L FeSO4溶液的pH为4.21,激光笔照溶液有丁达尔现象。【现象解释】新配制FeSO4溶液水解显酸性,说明反应I速率较快、程度较大。
FeSO4溶液变质探究
取两支试管标为①⑥,分别加人5mL0.1mol/LFeSO4溶液,试管 ①密封、试管⑥敞开。放置一段时间,观察溶液颜色,用激光笔照溶液;再分别取1mL试样于试管中,加两滴0.1mol/L KSCN溶液检验Fe3+。注意,Fe2+水解程度可据溶液的浑浊度(丁达尔现象)判断,Fe2+的氧化程度可据Fe3+遇KSCN的变色深浅判断。实验现象如表1所示。

实验结论
综合上述现象,我们可以得出铁粉、酸对FeSO4,保存溶液的影响:向密封FeSO4,溶液加过量纯铁粉可有效防上Fe2+氧化生成Fe3+,但Fe2+水解程度大,试管溶液中有较多黄色不溶物生成。
向密封FeSO4,溶液中加少量稀硫酸可以有效防止Fe2+水解,试管溶液一直澄清,但Fe2+氧化生成的Fe3+多。
向密封FeSO4,溶液中加少量稀硫酸、过量铁粉,短时间(24h内)可以防止Fe2+水解而加速Fe2+氧化,长时间(24h后)可以防止Fe2+氧化而加速Fe2+水解。
所以,保存FeSO4溶液加硫酸、铁粉各有利弊 。有的人提供保存FeSO4的方法与操作精确测定0.1mol/LFeSO4溶液pH为4.21<5),但Fe2+水解程度大,试管有较多黄色不溶物生成,此方法不能有效保存Fe2+溶液。
问题解决

我们认为保存硫酸亚铁溶液要重点防止Fe2+氧化,措施是除去氧、加铁粉;其次,防止Fe2+水解,措施是加稀硫酸。结合实验出现的反常现象,在实验中采取如下保存方法:向新配制0.1mol/LFeSO4溶液中加1mL2mol/L稀硫酸和过量纯铁粉,开始不塞紧橡皮塞(排除氧气),摇动试剂瓶待不再产生明显气体后塞紧配有“玻璃导管+气球”的橡皮塞(平衡气压,形成H2的还原气氛,减缓Fe2+氧化),装置如图1所示。实验证明,按照此保存方法,24h内FeSO4溶液几平不发生氧化和水解,适合做相关演示实验;若FeSO4溶液保存较长图1实验装时间(一周左右),待用时取出上清液于试管,加几滴稀硫酸防水解,再做相关演示实验,效果好。
当然,亚铁盐在保存、使用中,Fe2+的氧化和水解等变质现象不可避免,我们通过实验探究和理论分析,研究亚铁盐“相对合理”的保存方法,以期逐渐接近科学事实的真相,为化学实验提供参考。
相关文章:------------固体硫酸亚铁如何保存方法
相关文章:------------固体硫酸亚铁如何保存方法





